有機分子化学研究室では、新たな遷移金属触媒の設計と創製をもとに、意外性豊かな新反応および新変換法の開発を目指しています。合成化学分野において、新たな方法論を開発することは、有用な有機化合物の短行程合成を可能にするだけでなく、これまで合成が困難であった有機化合物の合成をも可能にします。我々は様々な遷移金属元素の多様な能力を引き出し、それを通じて新たな発見を行うことで、社会に貢献していきたいと考えています。現在、以下のテーマを中心に研究を進めています。
(1) 高機能キラルカルベン金属錯体触媒の開発
(2) 閉環アプローチによる置換芳香族化合物の選択的合成
(3) アダマンタン誘導体の合成
(4) 連続不斉反応による新触媒スクリーニングシステムの構築
|
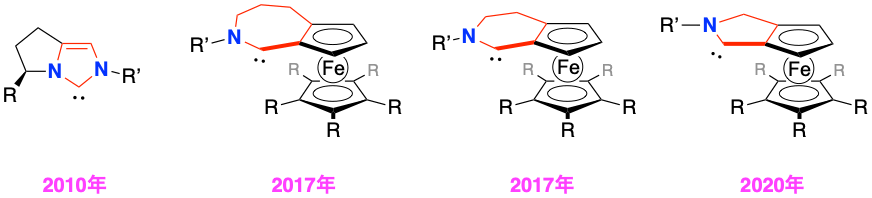
有機化合物は、医薬品、農薬、工業製品、先端材料物質として、我々の生活において欠かせない役割を果たしています。これらは現在、「有機合成化学」と呼ばれる技術を利用することで石油や石炭などの化石燃料をもとに合成されていますが、本技術は未だ発展途上であり、例えば原子効率や選択性といった諸問題の解決を行っていく必要があります。「有機合成化学」が抱える課題の中でもとりわけ、互いを鏡に映した構造関係にある鏡像異性体を選択的に作り分ける手法(不斉合成)の開発は、大変チャレンジングであることが知られています。これら鏡像異性体の物性が、旋光性を除いて同一であるため、両者間の反応性に差をもたらすことが困難だからです。
微量の不斉源より大量の鏡像異性体の合成を可能とする「触媒的不斉合成」は、このような課題を解決するための一つの理想的な手法として知られています。実際に、現在多くの有用な鏡像異性体の供給が「触媒的不斉合成」によって工業規模で実施されています。我々のグループでは、従来の不斉ホスフィン配位子が配位した金属錯体触媒の「安定性」に関する弱点を補うことで、より広範囲の触媒系に利用可能な新しい金属錯体触媒の開発を目指した研究を行っています。
1) Org. Lett. 2010, 12, 1764-1767.
2) Chem. Commun. 2015, 51, 15442-15445.
3) Chem. Lett. 2016, 45, 294-296.
4) Adv. Synth. Catal. 2017, 359, 255-259.
5) Tetrahedron: Asymmetry 2017, 28, 824-829.
6) Chem. Eur. J. 2017, 23, 16806-16812.
7) Chem. Eur. J. 2018, 24, 18575-18586.
8) Organometallics 2019, 38, 2211-2217.
9) J. Org. Chem. 2019, 84, 14291-14296.
10) J. Synth. Org. Chem. Jpn. 2020, 78, 28-40.
11) Bull. Chem. Soc. Jpn. 2020, 92, 200-204.
12) J. Org. Chem. 2022, 87, 3007-3013.
13) J. Org. Chem. 2024. 89, 11811-11817.
14) Asian J. Org. Chem. 2024, 13, e202400310.
15 Organometallics 2025, 44, online.
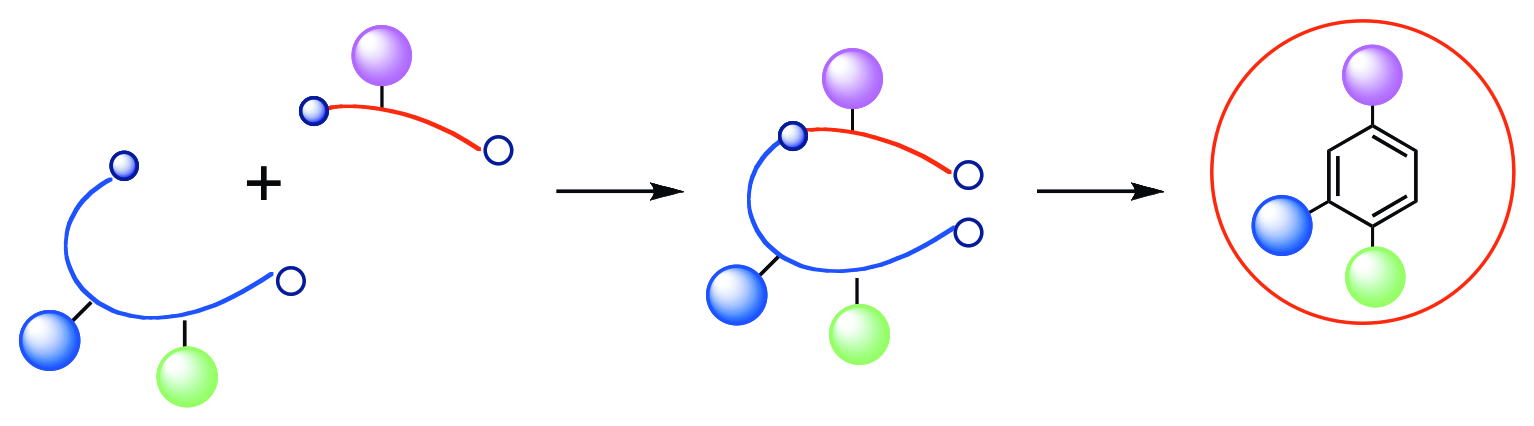
置換芳香族化合物は、現在、先端材料物質や工業薬品、医農薬品等における重要物質として幅広く利用されています。そのため、これらの有用な合成法の開発は重要な研究課題となっています。置換芳香族化合物を合成する従来法としては、芳香族求電子置換反応と呼ばれる反応が最も代表的でありますが、本手法は、一般に激しい条件下で反応を行わなければならないということと、分離困難な位置異性体の副生を伴いやすいという本質的かつ重要な問題点を抱えています。このことは、本手法によって得ることのできる置換芳香族化合物には合成的な制限があることを意味しています。そこで当研究室では、より複雑な芳香族化合物の需要に応えるべく、望みの位置に置換基をあらかじめ配置した非環状基質を選択的に合成し、このものを閉環/芳香族化させるというアプローチによって、目的の化合物を単一の生成物として得る新たな芳香族化合物合成法の開発研究を行なっています。
1) J. Am. Chem. Soc. 2005, 127, 10470-10471.
2) Chem. Asian J. 2006, 1, 611-613.
3) Synlett 2007, 1561-1564.
4) Chem. Commun. 2007, 3774-3776.
5) Bull. Chem. Soc. Jpn. 2008, 81, 1512-1517.
6) Chem. Eur. J. 2008, 14, 8246-8261.
7) Org. Lett. 2008, 10, 2777-2780.
8) Chem. Eur. J. 2008, 14, 9706-9713.
9) J. Synth. Org. Chem. Jpn. 2009, 67, 876-888.
10) Org. Lett. 2009, 11, 515-518.
11) J. Org. Chem. 2009, 74, 3632-3640.
12) Chem. Eur. J. 2011, 17, 344-349.
13) Adv. Synth. Catal. 2011, 353, 1229-1233.
14) Org. Lett. 2011, 13, 4762-4765.
15) J. Org. Chem. 2013, 78, 3464-3469.
16) J. Org. Chem. 2014, 79, 4231-4239.
17) Org. Lett. 2015, 17, 2286-2289.
18) ACS Catal. 2020, 10, 292-301.
19) Tetrahedron Lett. 2020, 61, 151476.
20) J. Org. Chem. 2020, 85, 6420-6428.
21) J. Org. Chem. 2023, 88, 14797-14802.
22) Chem. Eur. J. 2024, 30, e202400220.
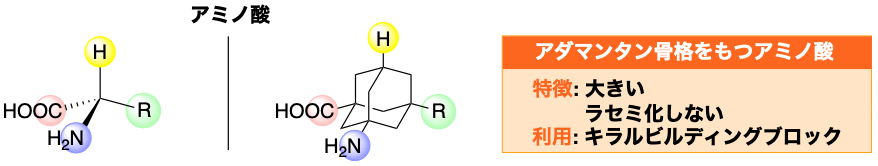
メタンの四つの水素原子を互いに直線で結ぶと、正四面体が出来上がるように、アダマンタンの橋頭位にある四つの水素原子を直線で結ぶと、正四面体が出来上がります。ここで重要なのは、後者の正四面体は前者の正四面体よりも大きいということです。我々は、アダマンタンをメタンの大きな類縁体と見立て、アダマンタン骨格をもつ様々なビルディングブロックの合成を行っています。
1) Adv. Synth. Catal. 2021, 363, 1662-1671.
| 連続不斉反応による新触媒スクリーニングシステムの構築 |
.jpg)
触媒的不斉合成によって合成された生成物の中には、ワークアップ前の段階で、その他の反応系においてそれ自身が不斉触媒となり得るものが存在します。そのため、ある触媒的不斉反応
(A→B*)によって合成した生成物を、後処理することなく他の触媒的不斉反応(C→D*)の触媒として連続的に利用すれば、一段階目の基質と反応試剤の組み合わせ次第で、二段階目の触媒(B*)を様々調製することができることになるため、効率的かつ強力な触媒スクリーニング法が確立できると期待できます。この際、仮に二段階の触媒反応がいずれも,1
mol% の触媒量で100% eeの生成物を100% 収率で与えたとすると,1分子の不斉源(Asymmetric Catalyst 1*)から10,000分子のホモキラル生成物(D*)が与えられることになります。すなわち、本概念では触媒反応の乗算効果によって格段に優れた不斉源の増幅も期待できることになります。本テーマではこのような考え方に基づき、二つの異なった触媒的不斉反応を高度に連結させることで、新たな反応場の構築を目指し、前例のない触媒活性種・生理活性化合物の創出を目指して研究を行っています。
1) Chem. Commun. 2009, 2923-2925.
2) Tetrahedron: Asymmetry 2011, 22, 1225-1230.
|
|
|